Food and Drug Administration
01. FDA( Food and Drug Administration : 미국식품의약품안전처)
FDA는 보건복지부 (DHHS)산하 기관이며 FD&C (Food, Drug and Cosmetics) 법과 몇몇 관련 국민보건법을 운영하는 주체로 통제 제품은 식품, 화장품, 의약품, 의료기기, 방사선, 생물학적 제품 등이 있다
02. FDA의 주요업무
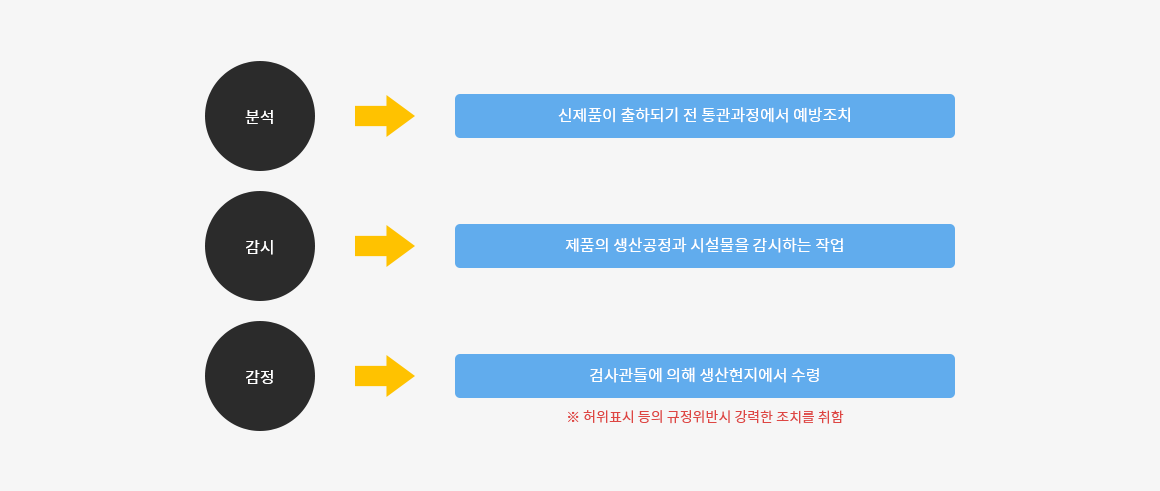
FDA는 분석, 감시, 감정의 3가지의 주요업무를 수행하고 있습니다. 분석 작업은 새로운 제품이 미국시장에 출하되기 전의 통관과정에서 수행할 수 있는 예방조치를 하기 위한 작업이며 감시업무는 제품의 생산공장과 시설물을 감시하는 작업으로 일선 검사관들에 의해 수행됩니다.
불순물 혼합 또는 허위표시 등의 규정위반에 대해서는 보다 강력한 제재조치를 취할 수 있는 기관입니다.
03. FDA 조직도
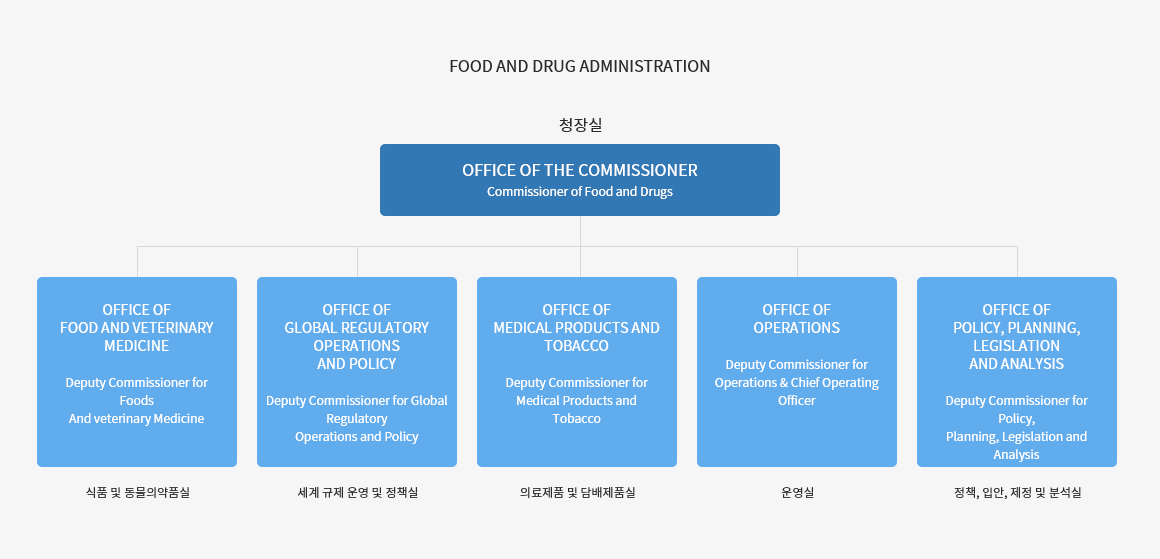
의료기기는 FDA의 의료제품 및 담배제품실 산하의 CDRH (Center for Devices and Radiological Health)에서 관리하고 있다.
04. FDA 의료기기 범위
| 가정용 의료기기 (over-the-Counter Device) | 내용 |
|---|---|
| 의료기기 종류 | 처방전 없이 소비자가 구입할 수 있는 의료기기 |
| 처방 의료기기(Prescription Device) | 의사의 감독, 사용지시에 따른 의료기기 |
| 임상시험 의료기기 (Investigational Device) | 개발단계에 있고 안전성 및 유효성의 목적에 대해서만 사람을 대상으로 이용하는 의료기기 |
| 응급 의료기기(Critical Device) | 생명의 유지, 지지에 이용되거나 인체에 삽입하는 것 그것이 불완전한 경우 중요한 장해가 당연히 일어날 수 있다고 여겨지는 GMP 규칙에 정의되어 있는 의료기기 |
05. FDA 의료기기 분류
의료기기를 안전성, 유효성에 따라 3등급으로 분류하여 등급에 따라 판매 전 허가절차를 달리하고 있습니다.
- Class Ⅰ : 일반규제(General Controls)
인체에 건강과 안전에 심각한 위험을 주지 않는 비교적 단순한 기능의 용구로서 적용되는 규제가 비교적 적은 편임.
품목코드에 따라 일부제품은 시판전 신고, 510(k)를 적용함 - Class Ⅱ : 일반규제 및 특별규제(General Controls and Special Controls)
일반규제요건만으로는 그 안전성과 효능을 장담할 수 없는 의료기기가 여기에 해당되며, 특히 전기장치가 내장된 제품은 Class II일 가능성이 큼.
품목코드에 따라 대부분은 510(k) 대상이며 일부 제품은 510(k) 면제 대상일 수 있음 - Class Ⅲ : 일반규제 및 시판 전 허가(General Controls and PMA: Premarket Approval)
인간의 생명을 유지시키는 데 쓰이거나 건강과 안전에 심각한 영향을 끼칠 수 있는 의료기기가 속함.
대부분 시판 전 승인(PMA)을 요구하며 품목코드에 따라 일부 제품은 510(k)를 적용하고 있음.
06. 510(k)의 3가지 형태
- Traditional 510(k)
- Special 510(k)
- Abbreviated 510(k)
07. Traditional 510(k)의 4단계
- Find a Predicate Device
- Locate Guidance Documents
- Format and Contents of a 510(k)
- Assemble a 510(k)