electrical Medical Device Reporting
01. 배경
2014년 2월 13일 eMDR에 대한 최종 가이던스(Doc. No. 2014-03279, final rule)가 발표되었다. 가이던스에 따르면 FDA는 지난 20년간 의료기기 사고 보고 시,
3500A 양식에 맞춰 작성된 MDR을 서면 보고했던 것과 달리 전자 제출(eMDR)을 요구하고 있다. FDA는 전자 제출을 통해 시간과 비용을 줄이고 효과적으로 보고를 받겠다는 입장이다.
최종 가이던스의 발표로 인하여 2015년 8월부로 ‘21 CFR Part 803’은 eMDR을 반영하도록 개정되었다. 이에 따라 모든 제조자는 사고 발생 이전에 반드시 eMDR 계정의 사전 등록을 수행해야 하며, 사고 발생 시 등록된 계정을 통해 eMDR을 수행해야 한다.
02. 강제 적용 시점
2015년 8월 14일 이후
03. Inspection 단계
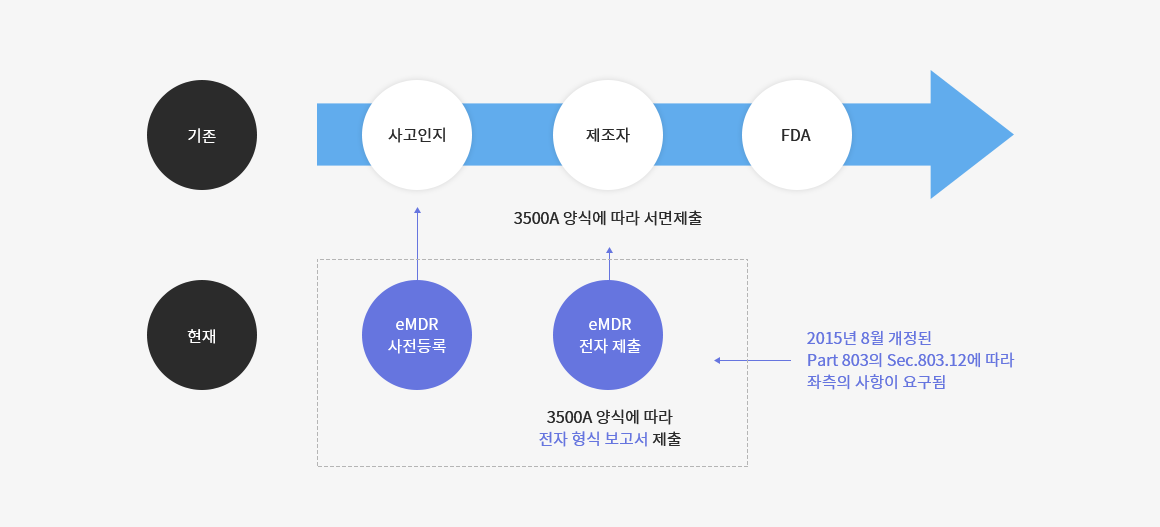
기존에는 제조자가 사고를 인지한 후 의료기기 사고를 보고하기 위해 사용하는 양식인 3500A 양식에 맞춰 문서를 작성하여 FDA에 서면 제출할 것을 요구하였다.
하지만 기존 방법에 앞서 사전 등록을 수행하며, 서면 제출 대신에 전자 형식의 보고서를 제출하도록 요구하고 있다.
04. 사전 등록 프로세스
다음 프로세스를 순서대로 진행하여 사전 등록을 진행한다.
- 1) WebTrader 테스트 계정 요청 메일 전달
- 2) 부인 방지 서한 작성 및 원본을 FDA에 전달
- 3) 개인 디지털 인증서 구입
- 4) 테스트 계정 등록
- 5) 계정 활성화 및 모의 사고 제출
- 6) 계정 승인 및 eMDR 계정 등록 완료
- 부인 방지 서한
- 메시지의 송수신 시, 사실 부인이 없음을 증명하는 서한
- 디지털 인증서
- 메시지의 송수신 시, 사실 부인이 없도록 하기 위한 인증서
- 사실 부인
- 실제로 사실이 일어났음에도, 이러한 사실을 부인하는 행위